Europa encontra “possíveis vínculos” entre casos raros de trombose e a vacina da AstraZeneca
Agência reafirma a “elevada eficácia” do imunizante na prevenção da doença e declara que os benefícios continuam sendo muito superiores aos riscos
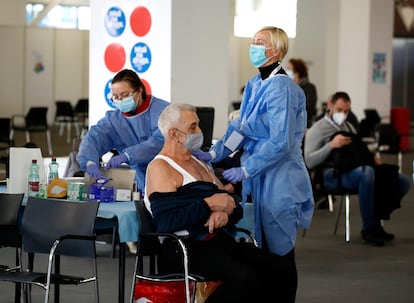

A Agência Europeia do Medicamento (EMA, na sigla em inglês) concluiu nesta quarta-feira que os coágulos sanguíneos devem ser incorporados como “efeitos secundários muito raros” da vacina da AstraZeneca, segundo o Comitê de Avaliação de Riscos da Farmacovigilância (PRAC) reunido desde terça para avaliar 86 casos de trombose relatados até agora pelas autoridades nacionais do continente, a maioria envolvendo mulheres com menos de 60 anos. A EMA, que não confirmou fatores de risco por idade nem gênero, continua considerando que os benefícios da vacina são muito superiores aos riscos que ela acarreta. “A vacina é altamente eficaz para salvar vidas, e a vacinação é extremamente importante”, afirmou a diretora-executiva da EMA, Emer Cooke. Depois da elaboração do relatório, caberá aos países decidirem que grupos populacionais receberão essa vacina. Os 27 ministros de Saúde do bloco europeu se reuniriam a partir das 13h (hora de Brasília) por videoconferência para definir as medidas decorrentes do novo relatório.
Aviso aos leitores: o EL PAÍS mantém abertas as informações essenciais sobre o coronavírus durante a crise. Se você quer apoiar nosso jornalismo, clique aqui para assinar.
“O risco de mortalidade pela covid-19 é muito maior que a mortalidade por estes efeitos secundários muito raros”, afirmou Cooke numa entrevista coletiva, falando em Amsterdã. A mensagem da EMA é clara: há um vínculo entre os coágulos detectados e a administração da vacina do laboratório anglo-sueco, mas se trata de casos muito raros, e os benefícios da vacina continuam se destacando. “A covid-19 é uma doença muito grave, e a vacina é efetiva para evitar a enfermidade, a hospitalização e a mortalidade. Em seu conjunto, o benefício é superior ao risco”, afirmou Sabine Straus, chefa do comitê de Segurança da EMA. A decisão foi tomada após uma análise também dos relatórios de especialistas independentes.
A EMA informou que por enquanto não há um tratamento específico para esses efeitos secundários. Os países deverão decidir como aplicam as conclusões desse relatório, em especial depois do alarme gerado pelos tropeços na comunicação por parte dos países e da própria EMA. Os Países Baixos e a Alemanha, por exemplo, haviam decidido administrar essa vacina apenas em maiores de 60 anos. Segundo a agência comunitária, a maioria dos casos analisados corresponde a mulheres com menos de 60 anos, que sofreram um coágulo nas duas semanas posteriores à administração da vacina. Entretanto, os especialistas comunitários consideram que essa circunstância não permite extrair conclusões gerais. Straus explicou que, por haver diferenças importantes entre os países na forma de administração da vacina, com mais prevalência do uso entre mulheres não idosas, não é possível concluir que esse grupo populacional tenha um risco maior.
Os casos de trombose investigados pela EMA —muito incomuns — haviam causado em meados de março uma suspensão do uso do medicamento em 16 países da União Europeia. Em suas primeiras avaliações, a EMA concluiu que a vacina era “segura e efetiva” e destacou que os benefícios que ela oferece à sociedade superam com sobras os riscos. O imunizante demonstrou uma eficácia de 100% na prevenção de casos graves de covid-19 e, diferentemente das vacinas da Pfizer-BioNTech e Moderna, pode ser conservadas em geladeiras comuns.
Essa primeira avaliação permitiu que a maioria dos países da UE reativassem seus processos de vacinação com a AstraZeneca. A EMA, porém, não descartou o vínculo com episódios tromboembólicos, mas informou que precisava investigar mais. Diante dos casos detectados pelas autoridades sanitárias, os Países Baixos e Alemanha decidiram utilizar o fármaco apenas em pessoas maiores de 60 anos. Na Espanha, seu uso, inicialmente aprovado apenas para pessoas de até 55 anos, foi ampliado para a faixa até 65. A presidência da UE, ocupada neste semestre por Portugal, convocou uma reunião de ministros da Saúde na tarde desta quarta para definir uma decisão conjunta que valha para os 27 países do bloco.
A EMA investigou 86 casos dessas tromboses raras, dos quais 62 eram cerebrais e 24 abdominais. Destes, 18 levaram à morte dos pacientes, segundo um comunicado distribuído pela agência europeia. A EMA vem insistindo em que se trata de episódios raros, uma vez que já foram administradas mais de nove milhões de doses na UE. Entretanto, as declarações de dois diretores da agência à mídia italiana nesta semana geraram ainda mais confusão sobre a possível associação com os coágulos, de modo que inclusive regiões como Castela e Leão (Espanha) decidiram suspender novamente a sua administração de forma cautelar, à espera do relatório da EMA, apesar do mal estar que essa decisão gerou no Governo espanhol.
O chefe de estratégia de vacinação da agência, Marco Cavalieri, afirmou no jornal italiano Il Messagero que, no seu entender, os vínculos entre a vacina e os casos de coagulação sanguínea eram “claros”. “Na minha opinião, podemos dizer, há claramente uma associação com a vacina. Entretanto, ainda não sabemos o que causa esta reação. Estas trombose cerebrais com déficit de plaquetas parecem ser o principal evento a investigar. Em resumo: nas próximas horas dirão que há uma conexão, mas ainda temos que entender como ela ocorre”, afirmou. Em outra entrevista, ao La Stampa, Armando Genazzani, outro diretor da EMA, afirmou que esse vínculo era “plausível”.
As declarações de ambos os diretores ocorreram no mesmo dia em que o Comitê de Avaliação de Riscos da Farmacovigilância da EMA se reunia para oferecer uma “recomendação atualizada” após analisar todos os episódios raros de trombose e ter estudado os trabalhos desenvolvidos por especialistas independentes. Ou seja, ambos os diretores estavam antecipando conclusões de uma reunião que dura toda a semana. O organismo advertiu que nenhuma decisão foi adotada por enquanto, mas marcou um pronunciamento para a tarde desta quarta a fim de explicar os resultados das análises.
Apoie a produção de notícias como esta. Assine o EL PAÍS por 30 dias por 1 US$
Clique aquiA vacina da AstraZeneca foi a terceira a receber a autorização da EMA e da Comissão Europeia para ser lançada no mercado. Antes, os produtos da Pfizer-BioNTech e Moderna haviam obtido o aval, e depois foi a vez da vacina da Janssen. A trajetória do medicamento na UE esteve sempre repleta de controvérsias, contratempos e esbarrões, depois que a empresa anglo-sueca reduziu repetidamente suas previsões de entregas, atrapalhando o calendário de vacinação do primeiro trimestre. Para arrematar, o medicamento foi questionado por causa dos coágulos e da falta de dados sobre sua eficácia em maiores de 65 anos. A EMA, entretanto, vem esclarecendo essas dúvidas: em plena terceira onda de contágios na UE, essa vacina se mostrou eficaz para reduzir contágios, internações e mortes.
REINO UNIDO DESACONSELHA VACINA PARA MENORES DE 30
O Reino Unido desaconselha o uso da vacina da AstraZeneca em menores de 30 anos. Assim anunciou nesta quarta-feira o Comitê Conjunto de Vacinação e Imunização (JCVI, na sigla em inglês), depois de ser detectado um possível vínculo entre o fármaco e casos muito pouco frequentes de trombose em adultos jovens.
Wei Shen Lim, presidente do Comitê de Vacinação do país, argumentou numa entrevista coletiva que seria preferível que este grupo de idade se vacinasse com as outras duas fórmulas aprovadas no país, da Pfizer e BioNTech e da Moderna. Quem preferir poderá continuar se vacinando com o produto da AstraZeneca.
O especialista do JCVI salientou que o anúncio se destinava apenas aos jovens, com menor risco de hospitalização por covid-19, e que essa medida estava sendo tomada “por precaução”, e não porque o comitê tenha dúvidas sobre a segurança da vacina. O medicamento, desenvolvido em parceria com a Universidade de Oxford, é o mais usado no país, e sua eficácia sempre foi defendida pelo Governo britânico. Foi assim inclusive quando vários países europeus decidiram suspender seu uso, em meados do mês passado, após a descoberta de alguns casos de trombose entre pessoas vacinadas com o fármaco, já injetado em dezenas de milhões de pessoas na Europa. “Como afirmaram os órgãos reguladores, esta vacina é segura, efetiva e já salvou milhares de vidas. A grande maioria da população deveria continuar a colocá-la quando a oferecerem”, declarou nesta quarta-feira o primeiro-ministro britânico, Boris Johnson.
A executiva-chefe da Agência Reguladora de Medicamentos e Produtos Sanitários do Reino Unido, June Raine, informou que até 31 de março foram registrados 79 casos de trombose com um baixo número de plaquetas em pessoas que receberam a primeira dose da AstraZeneca. Desse total, 19 pessoas morreram, sendo 3 delas menores de 30 anos – embora em alguns casos a causa seja desconhecida. Os pacientes afetados (51 mulheres e 28 homens) têm idades entre 18 e 79 anos, segundo Raine. O Reino Unido injetou mais de 18 milhões de doses da vacina da AstraZeneca até agora. Os órgãos reguladores continuam recomendando o fármaco em adultos maiores de 30 anos, por considerar que “os benefícios compensam com sobras os riscos”, nas palavras de Raine.
A Agência Reguladora esclareceu que os jovens de grupos prioritários, como do setor sanitário ou pessoas com um sistema imunológico debilitado, que tiverem recebido uma primeira dose da vacina da AstraZeneca devem receber a segunda conforme o calendário previsto.
Inscreva-se aqui para receber a newsletter diária do EL PAÍS Brasil: reportagens, análises, entrevistas exclusivas e as principais informações do dia no seu e-mail, de segunda a sexta. Inscreva-se também para receber nossa newsletter semanal aos sábados, com os destaques da cobertura na semana.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.








































