Pfizer solicita autorização de emergência para sua vacina contra a covid-19 nos Estados Unidos
É a primeira empresa farmacêutica a buscar a aprovação do órgão regulador norte-americano

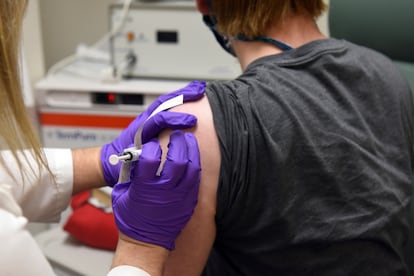
A agência de medicamentos dos Estados Unidos (FDA na sigla em inglês) estava avisada: a empresa farmacêutica Pfizer e sua parceira alemã BioNTech solicitaram nesta sexta-feira uma autorização de emergência para sua vacina contra a covid-19, tornando-se os primeiros fabricantes a fazê-lo nos Estados Unidos ou na Europa. A vacina poderia estar disponível em meados ou no final de dezembro para grupos de risco, segundo afirmou a empresa em um comunicado.
O anúncio era esperado há vários dias, depois da publicação dos resultados do teste clínico da fase 3 da vacina, que está em andamento desde julho com 44.000 voluntários em vários países e segundo os quais a vacina contra a covid-19 não teria efeitos colaterais graves. Na quarta-feira, a Pfizer anunciou que a vacina tem 95% de eficácia a partir de 28 dias após a primeira dose.
A Pfizer informou em um comunicado que, caso o pedido seja aprovado, sua vacina poderia começar a ser distribuída em dezembro em fases, começando pelos grupos de alto risco, incluindo profissionais de saúde, idosos e pessoas com problemas de saúde. Os trabalhadores essenciais, professores e pessoas sem-teto, bem como as que vivem em abrigos e prisões, provavelmente seriam os seguintes, e depois crianças e adultos jovens.
O Governo de Donald Trump planejou vacinar 20 milhões de pessoas pertencentes a esses grupos de risco, e depois entre 25 e 30 milhões de pessoas por mês. A velocidade desse processo não tem precedentes na história das vacinas. Em média, foram necessários oito anos para desenvolver as vacinas autorizadas na última década nos Estados Unidos.
Em março, a BioNTech propôs à Pfizer usar sua tecnologia inédita de RNA mensageiro no momento em que o mundo passava pelo primeiro confinamento. O primeiro voluntário recebeu a vacina no dia 23 de abril, na Alemanha, na primeira fase de testes. A fase 3, e última, começou em 27 de julho. Metade dos voluntários recebeu um placebo e a outra metade a vacina experimental, sem saber quem recebeu o quê. Os voluntários continuaram suas vidas normalmente, tomando os mesmos cuidados que a população em geral e progressivamente —com a explosão da pandemia nos Estados Unidos no outono— o número de casos de covid-19 entre o grupo placebo cresceu, mas não entre o grupo dos vacinados. Dos 170 casos registrados entre os participantes, 162 receberam o placebo e 8 a vacina, de acordo com comunicados dos fabricantes. As estatísticas indicam que uma pessoa vacinada tem 95% menos risco de contrair a doença do que uma não vacinada.
Uma vacina para o mundo
Espera-se que o processo de controle da FDA deve levar algumas semanas, e uma reunião do comitê assessor para analisar a vacina foi agendada para o início de dezembro. “A apresentação nos Estados Unidos representa um marco fundamental em nossa viagem para entregar uma vacina contra a covid-19 ao mundo, e agora temos uma imagem mais completa da eficácia e do perfil de segurança da nossa vacina, o que nos dá confiança em seu potencial”, disse o presidente e diretor executivo da Pfizer, Albert Bourla, em um comunicado.
O anúncio acontece dois dias depois de a Pfizer ter informado que em sua última avaliação da fase 3 a eficácia da vacina “era consistente segundo a idade, o gênero, a raça e a etnia” e que “a eficácia observada em adultos com mais de 65 anos era superior a 94%”. De acordo com a Pfizer, os dados demonstram que a vacina foi bem tolerada em todas as populações de seus participantes inscritos e que nenhum problema de segurança grave foi observado. Os únicos efeitos colaterais importantes foram fadiga (3,8%) e dor de cabeça (2%).
A Pfizer anunciou em 22 de julho que os Estados Unidos fizeram um acordo para comprar 100 milhões de doses de sua vacina por um total de 1,95 bilhão de dólares (cerca de 10,49 bilhões de reais) e a possibilidade de comprar 500 milhões de doses adicionais. A empresa espera produzir até 50 milhões de doses em nível mundial em 2020 e até 1,3 bilhão de doses até o final de 2021. Os Estados Unidos registraram 11.698.661 casos confirmados de coronavírus nesta quinta-feira e 252.419 mortes por covid-19, de acordo com a contagem independente da Universidade Johns Hopkins. O balanço representa um recorde absoluto de novos contágios, com 200.146 a mais em um dia, e também o maior número de mortes em 24 horas (2.239) desde o início de maio, em plena explosão da pandemia.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.








































