As vítimas brasileiras de um implante da Bayer que prometia esterilizar mulheres
Agência Pública em parceria com ICIJ revela que dezenas de mulheres no Brasil sofreram dores fortes, enjoo, perfurações e infecções no útero por dispositivo implantado no SUS
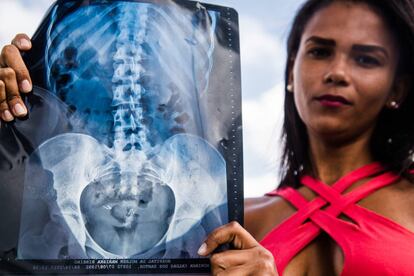
Em 2013, Adriana Caldas dos Santos procurou a rede pública de saúde do Rio de Janeiro para realizar uma esterilização. A carioca foi mãe pela primeira vez aos 16 anos e aos 21 já tinha dois filhos. A decisão foi tomada com o marido: se a situação financeira já estava difícil para a família, imagine se chegasse mais uma criança.
Moradora de Paciência, bairro da zona oeste carioca, Adriana buscou o serviço de planejamento familiar e comunicou sua vontade. Depois de ter participado das aulas obrigatórias, finalmente conseguiu uma vaga para fazer a laqueadura das trompas, mas no dia foi barrada por estar com infecção urinária. Precisou voltar ao posto de saúde e começar tudo de novo. Nesse ínterim, engravidou da terceira filha, o que aumentou sua resolução para buscar a laqueadura.
Na segunda tentativa, uma enfermeira do posto de saúde perto da sua casa contou do Essure, um método contraceptivo permanente e inovador que, segundo ela, “não exigia corte, era indolor e sem risco”. Tratava-se basicamente de duas molas a serem colocadas, por via vaginal, em cada uma das suas trompas, que seriam definitivamente bloqueadas, impedindo assim uma nova gravidez. Ela se interessou. Após ter dado à luz a sua bebê, assistiu a duas palestras no Hospital da Mulher Mariska Ribeiro, em Bangu, também na zona oeste do Rio, onde o procedimento seria feito. Poucos meses depois, em junho de 2016 e aos 23 anos, estava pronta para receber os implantes.
Mas o resultado não foi nada do que ela esperava. “Comecei a ter infecção urinária, manchas brancas no rosto, queda de cabelo. Minhas unhas começaram a quebrar, comecei a emagrecer muito, a perder apetite”, conta.
Quando as dores já duravam meses, um ultrassom detectou que uma das molas aparentemente teria se deslocado. Adriana foi diagnosticada com uma inflamação do endométrio, tecido que reveste o interior do útero. O prontuário médico dizia que a causa era um “corpo estranho” . “Quando falaram que iam remover o Essure, fiquei feliz porque não sabia o que estava me esperando”, desabafa. O procedimento, realizado em junho de 2017, exigiu a retirada completa das trompas e também do útero.

Não parou aí. Menos de dez dias depois, por complicações na primeira cirurgia, precisou passar por uma segunda, agora no abdômen, para fazer nele uma lavagem. Até hoje não há diagnóstico exato sobre o que deu errado na primeira operação. “Quando comecei a passar mal, que descobri ter sofrido um erro médico, foi desesperador. Eu não queria mais entrar no centro cirúrgico, estava com medo de não voltar”, relembra. “Foi um erro que me marcou muito, não só com sequelas, mas com traumas piores. Não quero que mais ninguém tenha esse dispositivo no corpo e passe a mesma coisa que eu passei.”
A história de Adriana ilustra um drama silencioso que tem afetado milhares de mulheres no mundo, mas é pouco conhecido por aqui. O dispositivo Essure, fabricado pela Bayer, tem sido apontado como causador de efeitos colaterais que colocam em risco a saúde de mulheres nos Estados Unidos e na Europa. Ao longo de dez meses, a Pública ouviu os relatos de mulheres que foram vítimas aqui no Brasil, como parte da megainvestigação “The Implant Files”, um projeto do International Consortium of Investigative Journalists (ICIJ) que reuniu 250 repórteres de 36 países para apurar histórias de dispositivos médicos problemáticos que são implantados em pacientes no mundo todo, trazendo enormes problemas.
No Brasil, o problema adquiriu a dimensão de saúde pública, uma vez que os implantes foram feitos em hospitais do SUS e as pacientes eram mulheres de baixa renda das periferias de capitais. Quando sentiam os efeitos colaterais, várias relataram terem sido ignoradas pelos médicos. “O Essure era para simplificar a minha vida, melhorar minha qualidade de vida e dos meus filhos, mas só piorou, só trouxe desgraça, desespero”, lamenta Adriana. “Confiei no médico, na palavra dele, e antes não tivesse confiado em ninguém, tivesse confiado na minha palavra, deixasse ter mais dois, três filhos e desse meu jeito para cuidar. Pelo menos acho que não estaria sofrendo, não teria perdido minha saúde.”
Em maio, numa tarde de quarta-feira, Adriana concedeu entrevista à Pública em frente ao Hospital Mariska Ribeiro. Ela estava com outras quatro mulheres que passavam por situação semelhante. “Eu deixava algumas vezes de fazer as coisas dentro de casa, de cuidar das minhas filhas, e ficava muito estressada por causa das dores”, disse Elaine Alves da Conceição, de 31 anos. “Estou me sentindo livre. Feliz, por ter conseguido. E menos preocupada”, desabafou Luana Patrícia Gomes da Silva Alves, de 29 anos, sobre a luta para retirar as molas.
As brasileiras que enfrentam complicações decorrentes do Essure se organizam em comunidades em redes sociais como o Facebook – a maior delas tem quase 600 membros –, onde compartilham suas experiências, aconselham e amparam umas às outras. A iniciativa existe também em outros países: no Facebook, o grupo “Essure Problems“, fundado em 2011 por uma norte-americana, conta com mais de 41.000 participantes.
Desde fevereiro, a Pública acompanha o grupo “Vítimas do Essure”, criado no WhatsApp um ano antes. Ele serve de espaço de discussão para 91 pessoas, entre mulheres que se queixam de efeitos colaterais do dispositivo e seus familiares. Um dos assuntos mais recorrentes é a retirada das molas. Aquelas que já se veem livres delas orientam as que estão em busca de removê-las. Para onde ir, a quem recorrer, como insistir: todo conselho é válido, já que uma das principais dificuldades encontradas por essas mulheres é o acesso aos procedimentos cirúrgicos capaz de remover o Essure de suas trompas no Sistema Único de Saúde.
Entre os 91 integrantes do grupo, há principalmente moradoras de baixa renda do Rio de Janeiro, São Paulo e Brasília. Todas receberam o implante em hospitais públicos, vinculados ao SUS. A maioria delas vive em bairros periféricos dessas grandes cidades, ou mesmo em municípios que compõem sua região metropolitana.
Dos Estados Unidos para os hospitais públicos do Brasil
O Essure consiste em um par de molas de 4 centímetros cujo diâmetro pode se expandir de 1,5 a 2 milímetros para se fixar nas paredes das tubas uterinas. Os stents possuem uma estrutura interna de aço inoxidável, circundada por fibras de tereftalato de polietileno (PET), e uma estrutura externa de Nitinol (liga metálica de níquel-titânio). As fibras PET estimulam o crescimento dos tecidos das trompas para que se infiltrem nas molas, o que resulta na obstrução da passagem e – segundo promete a atual fabricante, Bayer – na esterilização permanente das mulheres que recebem os microimplantes.
Desenvolvido nos anos 1990 pela empresa norte-americana Conceptus Inc., esse método contraceptivo é conhecido cientificamente como “esterilização por histeroscopia” – porque é feita com um histeroscópio, instrumento que dá ao médico a visão do interior do útero e das trompas, sem necessidade de corte cirúrgico. Como pode ser efetuada em ambulatório, de maneira breve (leva em média 10 minutos para ser concluída), por via vaginal e, portanto, com baixo impacto na vida da paciente, é considerada uma técnica minimamente invasiva se comparada à laqueadura das trompas, que demanda internação, cirurgia e aplicação de anestesia. Havia duas únicas exigências após a inserção do dispositivo: que a mulher utilizasse outro método anticoncepcional durante os 90 dias seguintes ao implante e que, ao final desse prazo, um exame de imagem fosse realizado para confirmar o posicionamento adequado das molas e, consequentemente, a esterilização.
Por conter essas características, o Essure surgiu como uma promessa de inovação ao universo da contracepção permanente. A primeira versão de sua bula expunha os problemas que poderia acarretar – no momento da inserção, dor, sangramento, náuseas ou desmaio; terminado o procedimento, mudanças no ciclo menstrual, dores no abdômen, pelve ou costas, doença inflamatória pélvica (DIP) e gravidez. No entanto, a fabricante garantia que, após um ano de uso, o produto apresentava 99,81% de efetividade.
Projetado como método definitivo, o Essure não pode ser removido sem causar consequências sérias ao sistema reprodutivo feminino. A mulher precisa se submeter a cirurgias de retirada das trompas ou, em casos mais delicados, o útero também precisa ser removido.
Em 2001, o dispositivo recebeu a marcação CE, certificado de que o produto cumpre os requisitos da União Europeia em matéria de segurança, eficácia e qualidade e, por isso, pode circular por seu território. Agora, a investigação “Implant Files” revelou que os critérios europeus são frágeis em relação a dispositivos médicos, levando muitos países do mundo a permitir a venda de implantes problemáticos.
No ano seguinte, em 2002, foi aprovado pela Food and Drug Administration (FDA), agência responsável por fiscalizar alimentos e medicamentos nos Estados Unidos.
Em 2013, a gigante farmacêutica alemã Bayer comprou a Conceptus Inc. por 1,1 bilhão de dólares e se tornou a fabricante e detentora dos direitos do Essure – a empresa estima que até hoje mais de 1 milhão de mulheres tenham colocado o implante em todo o mundo.
No Brasil, apenas em fevereiro de 2009 a Agência Nacional de Vigilância Sanitária (Anvisa) concedeu o registro ao Essure. Desde o início, sua importação e comercialização no país estiveram sob responsabilidade da Comercial Commed Produtos Hospitalares, sediada em São Paulo.
A partir de 2012, hospitais públicos passaram a oferecê-lo às pacientes que procuravam o SUS em busca de um método contraceptivo permanente. A Pública apurou que foram vendidos cerca de 8.000 dispositivos a hospitais públicos no Rio de Janeiro, São Paulo, Pará, Tocantins e Brasília, a um custo de cerca de 40 milhões de reais para o Estado.
Desde que chegou ao país, o Essure é visto como uma opção para otimizar a realização de esterilizações no SUS. “É uma questão de praticidade, você usar um método e a pessoa poder ir embora para casa, e você usar um método e a pessoa precisar ficar internada”, explica o ginecologista e obstetra Carlos Alberto Politano, membro da Comissão Nacional de Anticoncepção da Federação Brasileira das Associações de Ginecologia e Obstetrícia (Febrasgo).
O primeiro hospital público brasileiro a oferecer a implantação do Essure como parte de seu serviço de ginecologia foi a Maternidade-Escola de Vila Nova Cachoerinha, na zona norte de São Paulo, em 2012. No Diário Oficial do Município, há dois registros de compra do dispositivo para utilização no hospital: cem kits em 2010 e outros cem em 2011. Por cada dupla de molas, a prefeitura de São Paulo pagou 5.000 reais à Commed.
Já o Hospital Mariska Ribeiro, no Rio, adotou o procedimento em novembro de 2014 e realizou 3.700 implantes em cerca de três anos. Um documento de outubro de 2014 traz uma análise dos critérios técnicos que motivaram a instituição a investir na esterilização. São destacados benefícios às mulheres, como “ausência de incisões abdominais” e “rápida reintegração laboral”, mas também à própria unidade de saúde, como “redução dos gastos com internação e medicamentos”.
Há ainda a informação de que o Essure é 24% mais caro se comparado à laqueadura cirúrgica tradicional, mas cinco vezes mais produtivo em termos de quantidade e “não usa leitos físicos de internação hospitalar, ou salas cirúrgicas e recursos anestésicos”. Ou seja, uma economia para o hospital.

Mariska Ribeiro, o recordista de implantes
As cinco pacientes do Hospital Mariska Ribeiro entrevistadas pela Pública contaram com detalhes as dores e sintomas causados pelo Essure. Até o encontro de maio, algumas se conheciam apenas virtualmente. Mas a experiência em comum fazia com que parecessem amigas de anos.
Ficou evidente que o grupo de WhatsApp no qual se reúnem funciona como uma rede de apoio. “Se eu puder fazer de tudo para outras mulheres não colocarem isso, vou fazer sim. Até porque só quem coloca sabe o sofrimento depois para tirar, as dores que sente”, comentou Adriana Caldas dos Santos. “A gente só tem a nós mesmas para tirar dúvidas do que está acontecendo, como se fosse uma a médica da outra.”
Esse também era o sentimento da dona de casa Luana Patrícia Gomes da Silva Alves. Para ela, moradora de Santíssimo, em Campo Grande, zona oeste do Rio de Janeiro, é reconfortante estar rodeada de mulheres em situação semelhante à sua. “Como vi as outras meninas com o mesmo problema, pensei: ‘Gente, ainda bem que não sou a única’, porque é difícil. A união faz a força, então vamos nos juntar todo mundo para correr atrás do prejuízo”, afirmou.
Mãe de três filhos, Luana começou a sentir incômodos alguns meses depois de colocado o Essure no Mariska Ribeiro, em agosto de 2016: “Meu cabelo começou a cair, fiquei uma vez 15 dias com dores de cabeça, a menstruação vinha em excesso, tinha bastante dores na barriga, o peito ficava inchado, doendo bastante”. Ficou quase um ano e meio com as molas, até conseguir retirá-las das trompas em fevereiro deste ano. “Foi uma saga mesmo. Era um sentimento de achar que não conseguiria, era isso que passava na minha cabeça. Uma coisa que achei que fosse ser tão prática. Só não queria ter filho, não queria passar por uma cirurgia, até porque não tenho quem cuide dos meus filhos.”
O Mariska Ribeiro foi considerado centro de excelência para o Essure no Brasil e treinava médicos de outros lugares que desejavam aprender a técnica. A CEP28, organização social gestora do hospital desde sua inauguração, recebeu uma proposta da Commed para a obtenção de 4.160 kits do produto com o preço de 5.000 reais cada um. As mais de 4.000 duplas de molas destinadas ao Mariska Ribeiro custariam 20.8 milhões de reais. Acrescidas as despesas com pessoal, o total previsto era de mais de 24 milhões. O valor efetivamente gasto, segundo apurou a Pública, ultrapassou os 18 milhões.
A meta do hospital era efetivar até 4.160 procedimentos de microimplantes entre novembro de 2014 e junho de 2016, isto é, 208 por mês. De acordo com Laura Osthoff, à época chefe de ginecologia e hoje diretora geral do hospital, aproximadamente 3.700 mulheres receberam o Essure no Mariska Ribeiro – conforme a Pública verificou, esse foi o hospital que mais vezes implantou o dispositivo no país. Em outubro de 2017 foram colocados os últimos kits.
O trajeto que as pacientes percorrem até o ambulatório em Bangu para fazer a laqueadura histeroscópica é comum aos demais hospitais e passa pelos serviços de planejamento familiar da rede pública de saúde. “A gente recebia da Secretaria de Saúde [do município do Rio de Janeiro], através do Sistema de Regulação [Sisreg, do SUS], as mulheres que já haviam feito previamente o seu planejamento familiar. As pacientes e seus companheiros frequentam a saúde básica, e lá são oferecidos os métodos anticoncepcionais que temos disponíveis: pílulas, preservativos, DIUs. As que optaram pela laqueadura tubária entraram numa fila do sistema de regulação do município do Rio de Janeiro”, declara Laura.
No Mariska Ribeiro, Laura garante que todas as informações, inclusive os riscos inerentes à técnica, foram disponibilizadas às interessadas. “Por ser um método não muito divulgado aqui, nós tivemos a maior preocupação de informar essas pacientes.” Ela explica que, em uma visita anterior à da inserção dos implantes, as mulheres são chamadas ao hospital para assistir a uma espécie de palestra sobre o produto. “Essa aula que foi dada para os pacientes leva em torno de 40 minutos a uma hora. Depois disso é oferecido à paciente o [termo] de consentimento informado, e elas levam um folder para casa para lerem com calma, junto com o marido, amigo, irmã, para depois virem tirar as dúvidas com a gente”, complementa.
De fato, o termo de ciência e consentimento pós-informado era distribuído a quem assistiu à aula. O documento comunicava sobre as eventuais complicações que a implantação dos stents poderia acarretar, como perfurações de órgãos e migração do dispositivo. No entanto, são frequentes os relatos de que os profissionais não só do Mariska Ribeiro, mas também de outros hospitais, davam mais peso às vantagens do Essure do que aos riscos no momento de explicar o método às pacientes.
“Ela [enfermeira] deu esse papel pra gente assinar, meu marido também assinou. Ele até fez um monte de perguntas, e ela falou que era 100% seguro, que isso [o termo] era a bula, os riscos, mas eles não existiam, nunca haviam sido constatados. De todos [os implantes] que ela tinha colocado, nunca havia tido uma reclamação, ou seja, era 100% seguro, não era nem 99%, era 100%”, relata Adriana Caldas dos Santos.
No termo, uma das afirmações com a qual a paciente precisava assentir era: “não tenho alergia a joias ou bijuterias, que quando uso bijuterias eu não fico com a pele irritada, ou com coceira e que não surgem manchas vermelhas. Que não tenho alergia conhecida a níquel ou titânio”. Isso porque um dos efeitos colaterais atribuídos ao Essure é a hipersensibilidade ao níquel ou a outro de seus componentes, que pode causar reações alérgicas. O atual rótulo do dispositivo nos Estados Unidos insere esse problema como um potencial risco a longo prazo: “sintomas reportados por mulheres portadoras do Essure que podem estar associados a uma reação alérgica incluem urticária, erupção cutânea, inchaço e coceira”, informa o texto.
Em nota, a Secretaria Municipal de Saúde do Rio de Janeiro reforçou que “as usuárias submetidas ao procedimento Essure” no Hospital Mariksa Ribeiro “participaram de palestras educativas com profissionais de saúde com informações sobre o procedimento” e que houve a assinatura de um termo de consentimento informado. “É importante esclarecer que o acolhimento, a assistência e as informações foram disponibilizadas para as usuárias em todas as etapas do atendimento”, comunica o texto.

Outros hospitais
Em quatro estados – São Paulo, Rio de Janeiro, Pará e Tocantins – e no Distrito Federal houve projetos desenvolvidos pelo sistema público de saúde que ofereciam o Essure como alternativa à laqueadura. O Ministério da Saúde não respondeu aos pedidos da reportagem por mais informações, mesmo aqueles feitos via Lei de Acesso à Informação (LAI).
A Pública conversou com mulheres esterilizadas por meio do dispositivo em quatro instituições públicas, além do Mariska Ribeiro: Hospital Pérola Byington, Hospital Maternidade Interlagos e Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (FMUSP), em São Paulo, e Hospital Materno Infantil de Brasília, no Distrito Federal.
Em fevereiro de 2015, o Hospital das Clínicas (HC) da USP lançou um chamado público em busca de 500 mulheres que desejassem participar de estudo sobre o Essure. O projeto era comandado por Walter Pinheiro, diretor administrativo de ginecologia e coordenador de histeroscopia do hospital – ele não atendeu às solicitações de entrevistas da reportagem.
Também naquele mês de fevereiro, o programa conduzido por Pinheiro foi tema de nota no Diário Oficial de São Paulo. Pouco mais de um ano antes, em janeiro de 2014, outro texto sobre o Essure havia sido publicado, informando que, àquela época, o método já estava disponível na “rotina de atendimento às pacientes do hospital” e que em pouco tempo seria ofertado ao público externo, como ocorreu cerca de 13 meses depois.
A professora de ensino infantil Christiane Virgínia Millions, de 39 anos, foi uma das mulheres que encontrou na internet o chamado divulgado pelo HC.
Mãe de três filhos, pensava em fazer uma laqueadura tradicional, mas achou a proposta do HC interessante e decidiu tentar. Em junho de 2015, teve o dispositivo implantado. A primeira mudança sentida foi no ciclo menstrual, que ficou irregular e mais intenso. Em seguida, vieram a queda de cabelo, o inchaço na barriga e as dores, que se mantiveram constantes e passaram a atrapalhar seu trabalho. “Sento muito no chão com as crianças, e comecei a perceber que, cada vez que me levantava rápido, parecia que estava enfiando uma agulha na lateral [do abdômen]”, explica.
“Tempestade em copo d’água”
Em março, Christiane procurou o HC para relatar os sintomas e foi orientada a visitar um ginecologista. Pelo plano de saúde, realizou ultrassons, que não permitiram ao médico visualizar as molas. Precisou, então, voltar ao HC, já com a ideia de removê-las. “Falei [na consulta] que queria tirar, mas a médica disse que não via necessidade. Que, se estava ali por conta de relatos de Internet, o pessoal está fazendo muita tempestade em copo d’água”, afirma.
Preocupada em sofrer futuramente com um câncer no útero, ela pretende conseguir a retirada por vias legais. “Você tem que brigar, fazer escândalo, ficar discutindo. Mas também tenho medo de discutir, fazerem de qualquer jeito e aí me prejudicar mais ainda na parte da saúde. Vou tentar pela Justiça porque aí não preciso ficar discutindo. Quando fui colocar o Essure, não precisei discutir com ninguém, por que agora vou ficar brigando?”, questiona.
O sentimento de Christiane, no final das contas, é de arrependimento e revolta. “A gente foi com uma intenção, achando que ia ser a oitava maravilha do mundo, e, na realidade, não foi. Estamos correndo risco de estar com o Essure. Falo isso baseada nos relatos que vejo”, desabafa. “Eu estava confiando justamente por ser o Hospital das Clínicas. Não imaginei em nenhum momento que alguma coisa poderia dar errado.”
Em nota, o HC informou que as pacientes que tiveram “este dispositivo intratubário implantado seguem em acompanhamento médico” e que todas elas receberam esclarecimentos prévios sobre o método a ser utilizado.
Vítimas ignoradas
Assim como Christiane, diversas vítimas relataram à Pública o tormento que é tentar levar problemas relacionados ao Essure aos hospitais onde foi implantado. São comuns as mulheres que contam ter sido desacreditadas no momento de comunicar aos profissionais de saúde sintomas colaterais do dispositivo. Dores, queda de cabelo, inchaço no abdômen e alterações no ciclo menstrual são apenas algumas das queixas mais citadas pelas integrantes do “Vítimas do Essure”. Algumas chegaram a desenvolver inflamações pélvicas após a colocação das molas.
Esse é o caso da dona de casa Elaine Alves da Conceição, moradora de Bangu, no Rio de Janeiro. Mãe de três filhos, ela não queria mais engravidar e decidiu procurar o serviço de planejamento familiar em busca de uma esterilização cirúrgica – a “laqueadura antiga, normal”, como descreve.
Encaminhada ao Hospital Mariska Ribeiro, foi apresentada ao Essure: “Quando vim para cá, disseram que estavam fazendo só esse tipo de procedimento”, contou. “Achei que seria melhor porque não precisaria me internar, já que tenho três crianças pequenas.”
Em novembro de 2016, recebeu os microimplantes. Sentiu cólicas desde o início, ocorrência dentro do esperado nos dias seguintes à inserção. As dores, no entanto, não cessaram – “na lombar, abaixo da barriga, cólicas muito fortes” –, mesmo com a confirmação, por ultrassom realizado três meses após a colocação, de que os stents estavam adequadamente posicionados. A menstruação também foi alterada: ficou oito meses sem ocorrer.
Elaine informou seu quadro a médicos do Mariska Ribeiro, mas foi apenas por meio de consulta com um ginecologista particular e exames pagos que descobriu sofrer de doença inflamatória pélvica. Só depois de uma nova tomografia conseguiu fazer a histerectomia no mesmo hospital onde, um ano antes, havia sido esterilizada, o Mariska Ribeiro.
“Eu falava com o médico, tentava explicar a situação, que eu não estava bem com aquilo. Não era nem que quisesse fazer uma outra operação, porque não queria passar por uma quarta cesárea, só queria me ver livre daquelas dores que eu estava sentindo”, relembrou Elaine. “Foi demorado, tive que tirar dinheiro do meu próprio bolso para fazer os exames. Venci o médico mais pelo cansaço mesmo, porque ele viu que eu estava insistindo.”
A também dona de casa Luana Patrícia Gomes da Silva Alves afirmou ter passado por situação semelhante. De acordo com ela, a médica que costumava atendê-la no Mariska Ribeiro era “atenciosa”, mas “sempre tirava o Essure de vista”. “Ela também falava que a falta que o meu organismo sentia do anticoncepcional poderia estar acarretando isso. Sabe quando o sexto sentido fala ‘não, não é’?”, questionou.
“A pior parte de todas era que a gente não tinha apoio de ninguém. Os médicos falavam que não era, e aí? Tudo depende de médico. Se vai em outro médico que não está sabendo do procedimento, eles lavam as mãos, dizem ‘a gente não pode cuidar de você se a gente não entende, não sabe’. A gente se sentia sem apoio.”
Procurada, a Secretaria Municipal de Saúde do Rio de Janeiro afirmou que “o Hospital da Mulher Mariska Ribeiro oferece suporte assistencial e está à disposição das usuárias que realizaram o procedimento para esclarecer eventuais dúvidas.”
A Pública tentou obter o número exato de “eventos adversos” relacionados ao Essure – situações que afetem a segurança de pacientes. Pela LAI, o órgão disponibilizou registros referentes a todos os produtos de saúde brasileiros de 2013 a 2018, mas suprimiu o nome comercial dos dispositivos e dos fabricantes. A reportagem recorreu duas vezes e o governo federal seguiu negando a informação.
Batalha na Justiça
Nos Estados Unidos, país onde o Essure foi mais utilizado, são no mínimo 26.700 notificações de eventos adversos atribuídos a ele, segundo a FDA. O ICIJ apurou que, entre os registros, há cerca de 8.500 ocorrências ao longo da última década em que os implantes precisaram ser removidos do corpo das pacientes.
As vítimas norte-americanas há anos buscam na Justiça indenizações pelos problemas que o Essure lhes causou. A própria Bayer admitiu, no início de 2018, ser alvo de ações que representam mais de 16.000 pacientes no país.
No Brasil, esse movimento apenas está começando. Pelo menos duas mulheres entrevistadas pela reportagem já tomaram medidas legais contra a multinacional e a Commed. Uma delas é Adriana Caldas dos Santos, que, além das duas empresas, a Commed e a Bayer, processou também o município do Rio de Janeiro, ao qual está vinculado o Hospital Mariska Ribeiro, por erro médico durante a cirurgia de retirada do útero e trompas. A ação, que corre na 16ª Vara de Fazenda Pública do Tribunal de Justiça do Rio de Janeiro, pede indenização por danos materiais.
Desde setembro, a carioca Genilma dos Santos Dias Amaral, de 36 anos, também move processo contra a Bayer e a Commed. O motivo de sua insatisfação com o Essure, implantado no Mariska Ribeiro em setembro de 2015, veio quase três anos após a colocação do dispositivo: Genilma acaba de se tornar mãe pela terceira vez. Ela é uma das pelo menos sete mulheres do grupo “Vítimas do Essure” que se viram grávidas mesmo depois de terem sido, na teoria, esterilizadas pelas molas.
A gestação inesperada, descoberta em março, abalou a rotina da família, que havia acabado de comprar uma casa em Santa Cruz, na zona oeste do Rio de Janeiro. “Nós somos pobres, somos simples, fizemos o maior esforço, compramos uma casa, ainda estamos pagando. Antes de engravidar, falei para o meu marido: ‘A gente vai fazer um esforço para pagar a casa – é mil reais todo mês –, então vamos deixar de sair, de levar as crianças no cinema, vamos cortar muitos gastos’. E aí descobri que estava grávida”, conta.
Genilma trabalhava como operadora de caixa em uma ótica, mas precisou se afastar do emprego. Ela ficou quase um mês internada com quadro de hiperêmese gravídica, caracterizado por enjoos e vômitos muitos intensos durante a gestação, cujas causas podem estar relacionadas a fatores psicológicos. “Quase entrei em depressão, tive muita força pra sair desse quadro depressivo que eu fiquei. Foi um choque muito grande para mim”, conta.
O processo de Genilma tramita na 1ª Vara Cível do Rio de Janeiro e pede reparação de danos morais e materiais. “Ela teve que se ausentar do trabalho. Em segundo lugar, vem a questão do custo que ela terá ao longo de anos para criar o filho até a maioridade”, aponta Cledson Barbosa Lobo, advogado do caso. “O dano moral é devido à falha do produto, às complicações e ao transtorno que ela teve, sobretudo na questão psicológica.”
Novos processos vêm por aí. Pelo menos outras 40 mulheres do Rio de Janeiro, São Paulo, Distrito Federal e Pará já procuraram o advogado carioca Luiz Claudio Ramos da Silva para buscar medidas legais contra a fabricante e a distribuidora do Essure no Brasil. Ramos afirma que está na fase de pesquisa e coleta de documentação, mas que ainda este ano o material reunido deve se transformar em ações judiciais.
Idas e vindas na Anvisa
O relato de eventos adversos e a mobilização de mulheres norte-americanas motivaram a FDA a iniciar em 2015 um processo de investigação sobre a segurança do Essure. Uma série de medidas foi tomada, entre elas a revisão dos estudos pós-aprovação fornecidos pela fabricante e a realização de um painel sobre o assunto pelo Comitê Consultivo sobre Produtos para a Saúde em setembro de 2015.
Ações significativas resultaram desse movimento: primeiro, a demanda à Bayer por um estudo de vigilância para a obtenção de informações mais completas sobre riscos e benefícios do dispositivo. Além disso, houve a publicação, em novembro de 2016, de novas diretrizes para o conteúdo e linguagem da rotulagem do Essure – os membros do painel recomendaram a adoção de “métodos mais agressivos” para garantir que os pacientes estejam mais bem informados sobre os riscos de um método contraceptivo ao escolhê-lo. Para terminar, foi elaborada uma lista sobre as vantagens e desvantagens do microimplante, a ser minuciosamente analisada por médicos e usuárias antes de decidir se utilizá-lo ou não.
Em maio de 2016, a Health Canada, autoridade regulatória em saúde do país, emitiu um alerta destacando as complicações apresentadas por mulheres canadenses portadoras do dispositivo – entre elas gravidez indesejada, perfuração e migração.
Essas duas situações motivaram ações da Anvisa, que resultaram em uma negociação que tinha, de um lado, a agência, e do outro, o lobby da Bayer e da Comercial Commed Produtos Hospitalares, responsáveis pelo Essure no Brasil.
Por meio da LAI, a Pública obteve a íntegra do processo de quase 300 páginas que traz detalhes sobre a negociação travada entre as partes e a pressão das empresas sobre a Anvisa para reverter sanções impostas ao Essure.
Tudo começa em 23 de junho de 2016, quando a Gerência de Tecnologia de Materiais de Uso em Saúde (Gemat) da Anvisa encaminhou digitalmente à Commed documento com novas exigências técnicas sobre o Essure: um estudo clínico sobre o produto, com acompanhamento mínimo de cada paciente por um período de 12 meses; um relatório de gerenciamento de risco atualizado; e a descrição das medidas efetivadas após o alerta emitido pela Health Canada. O prazo era de 120 dias.
A empresa, no entanto, não se manifestou no período estabelecido. Mais tarde, alegou que havia sido um engano de um de seus funcionários, que teria visualizado a demanda sem tomar as providências. A Gemat, então, pediu a outra divisão, a Gerência de Inspeção e Fiscalização de Produtos para Saúde, Saneantes e Cosméticos (Gipro), que avaliasse a situação e suspendesse a importação e comercialização do Essure. A solicitação foi acatada apenas no ano seguinte, em 17 de fevereiro de 2017. Nesse dia a Diretoria de Controle e Monitoramento Sanitários (Dimon) expediu a resolução RE Nº 457 , que determinou a suspensão da importação, distribuição e comercialização, do uso e divulgação do produto, além do recolhimento de todos os dispositivos distribuídos ao mercado.
Logo após a publicação da resolução no Diário Oficial da União, a Anvisa divulgou nota técnica explicando a medida e destacando que poderia rever o ato normativo “a partir da obtenção ou envio das informações solicitadas ao detentor do registro do referido produto no Brasil”. O informe trazia orientações às mulheres portadoras do implante, entre elas o preenchimento de um formulário online sobre o uso do dispositivo e eventuais eventos adversos observados.
Também via LAI, a Pública teve acesso aos resultados do questionário: apenas 22 mulheres responderam às perguntas, mas entre elas 21 afirmaram ter sofrido algum tipo de problema após a colocação das molas. O mais comum são as dores: 21 disseram tê-las sentido em alguma medida no abdômen, pelve, cabeça ou costas. Em seguida, vêm as cólicas, com 19 menções; sangramento vaginal irregular ou intenso (16); inchaço no abdômen, (13); alterações de humor, incluindo depressão (7); e uma afirmou ter sofrido perfuração no útero. Duas mulheres atestaram ter ficado grávidas mesmo com o Essure.
Em fevereiro de 2017, a Commed pediu acesso aos documentos que embasaram a decisão da Anvisa e passou a atuar para a volta do Essure ao mercado, com uma série de reuniões presenciais em Brasília. Em 2 de março, ocorreu a primeira de quatro reuniões na sede da Anvisa, em Brasília, entre funcionários da agência, Commed e Bayer. Na ocasião, segundo consta na ata, a área técnica do órgão reforçou que a revogação da resolução de fevereiro estava sujeita ao “cumprimento satisfatório das exigências emitidas”. A Bayer, então, pediu um novo encontro com os técnicos da Anvisa para discutir a documentação requisitada. Dessa vez, seria trazido do exterior um representante da matriz global especialista no produto.
Cinco dias depois, em 7 de março, o pedido foi atendido e integrantes da Commed, Bayer e servidores da Anvisa se reuniram novamente. Ficou acertado que a multinacional fabricante do Essure apresentaria uma série de documentos: estudos em andamento comparando laqueadura tradicional à histeroscópica, dossiê completo com todos os dados disponíveis sobre o produto, diretrizes para um programa de acompanhamento de profissionais que trabalham com o implante do dispositivo e programa de acompanhamento de pacientes a ser apresentado.
Passado mais de um mês, em 11 de abril, a Commed encaminhou à Anvisa os relatórios prometidos, que incluíam quatro estudos clínicos e o detalhamento das ações tomadas no Canadá em resposta ao alerta emitido pela autoridade regulatória do país.
Segundo a Pública apurou, não foi enviado nenhum estudo feito no Brasil depois da manifestação da Anvisa.
A empresa acrescentou que a Bayer havia promovido mudanças na rotulagem do Essure em todos os países, exceto nos Estados Unidos, e que a revisão estava sob análise de autoridades europeias. Assim que aprovada, a atualização do rótulo seria também submetida à Anvisa, assegurou.
Em 20 de abril, a terceira reunião em dois meses foi realizada entre as partes. Commed e Bayer fizeram pressão e questionaram a Anvisa sobre a reversão da suspensão de seu produto, mas as gerências presentes informaram que ainda não haviam analisado os documentos enviados e que um ofício seria encaminhado à Commed caso a conclusão fosse favorável. Após oito dias, no quarto encontro, o mesmo posicionamento: “Ao final da análise, a área técnica se manifestará pelos canais oficiais”.
Em 11 de maio, a Commed tentou novamente agilizar o processo e enviou à Anvisa carta requisitando mais uma vez a revogação da resolução de 17 de fevereiro, argumentando que as demandas da agência haviam sido “integralmente atendidas”. Somente em 6 de junho, entretanto, o pedido da empresa foi recebido pela Coordenação de Inspeção e Fiscalização de Produtos para a Saúde (CPROD) e encaminhado à titular da Gemat. Dez dias se passaram até que a gerente do departamento, Priscilla Consigliero de Rezende Martins, concedesse parecer favorável à documentação fornecida pela Commed e considerasse sanada a motivação inicial da suspensão. Para isso, a CPROD exigiu mudanças na rotulagem do Essure e a elaboração de uma lista contendo os riscos e benefícios do Essure a ser examinada por pacientes e médicos também no Brasil.
Essas medidas nem chegaram a ser implementadas, já que pouco tempo depois a Bayer anunciou o fim das vendas do produto em todo o mundo. Em 7 de julho, a suspensão ao Essure foi revogada pela resolução RE N° 1.846.E em 5 de setembro, a CPROD sugeriu o arquivamento do processo de investigação do Essure.
A derrocada do Essure
Antes de tomar medidas para reanalisar a segurança e efetividade do Essure, a FDA foi criticada por integrantes da comunidade médica. Três pesquisadores da Universidade Yale publicaram em setembro de 2015 um artigo na revista científica The New England Journal of Medicine em que contestam a qualidade das análises de informações pré e pós-comercialização do produto e a divulgação de estudos sobre ele, que, nas palavras dos médicos, deveria ter sido mais “oportuna e transparente”.
Outro artigo, de autoria de quatro pesquisadores da Universidade Cornell, em Nova York, divulgado em outubro de 2015 pela British Medical Journal, publicação científica britânica sobre medicina, constatou que mulheres submetidas à esterilização histeroscópica têm risco dez vezes maior de precisar fazer uma nova cirurgia em comparação às que realizaram a laqueadura por laparoscopia. “Benefícios e riscos de ambos os procedimentos devem ser discutidos com os pacientes para basear decisões conscientes”, conclui a pesquisa.
Após uma série de críticas e milhares de processos judiciais no mundo todo, no primeiro semestre de 2017 a Bayer encerrou as vendas do Essure em alguns países. O primeiro deles foi a Holanda, em 29 de maio, seguida pela Finlândia e pelo Canadá. Em todos os casos, a multinacional citou argumentos vagos como a “mudança na demanda” pelo produto ou “razões comerciais” para justificar publicamente sua decisão. Em agosto de 2017, a agência reguladora da Irlanda, rejeitou a renovação da aprovação do dispositivo, o que o impossibilitou de circular pela União Europeia.
No mês seguinte, em setembro, a empresa anunciou o fim da comercialização do Essure em todos os países do mundo, exceto nos Estados Unidos.
À época, comunicado divulgado pelo site de sua filial francesa – o texto não está mais disponível – informou que a intenção da companhia era “tranquilizar as pacientes, especialmente as que usam o Essure, assim como todos os profissionais médicos que as tratam”. Mas que a decisão não estava “relacionada com um problema de segurança, ou de qualidade do produto”.
Logo após o anúncio, o advogado francês Charles Joseph-Oudin, que representa mulheres francesas em processos contra a Bayer, afirmou que a medida deveria ser comemorada pelas vítimas do dispositivo, mas que elas, entretanto, não poderiam “ficar satisfeitas com os motivos econômicos alegados” e deveriam exigir explicações mais completas.
A Pública enviou à Bayer Brasil pedidos de entrevistas e questionamentos sobre o uso do dispositivo no país, mas obteve como resposta apenas uma nota informando que ele não está mais “sendo importado, distribuído ou comercializado” no Brasil “por questões estratégicas de negócios”.
Após a reviravolta mundial em relação ao Essure, a FDA fechou ainda mais o cerco ao produto. Em abril deste ano, restringiu suas vendas a médicos e unidades de saúde que utilizavam a lista abordando as vantagens e desvantagens do implante. “A FDA aprovou essa nova medida para assegurar que o dispositivo atenda aos nossos padrões de garantia de segurança e eficácia”, explica o órgão.
A retirada do Essure do mercado norte-americano ocorreu poucos meses depois, em julho, quando a empresa comunicou publicamente que, após 31 de dezembro, ele não mais será vendido no país. Em nota ao ICIJ, além de reforçar que a decisão se deu por motivos comerciais, a Bayer declarou que houve um declínio no uso de anticoncepcionais permanentes e que existe “publicidade enganosa e incorreta a respeito do dispositivo.” Segundo a multinacional, os processos que está sofrendo nos Estados Unidos são de autoria das mesmas mulheres que geraram muitos dos relatórios de acontecimentos adversos apresentados à FDA.
Esta reportagem faz parte do Implant Files, projeto do Consórcio Internacional de Jornalistas Investigativos, o ICIJ, com sede em Washington, DC. O Implant Files reúne 252 profissionais de 59 veículos de 36 países, que investigaram dezenas de fabricantes e distribuidoras de dispositivos médicos em todo o mundo. No Brasil, participam da apuração a Agência Pública e a revista piauí.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.








































