Cientistas eliminam pela primeira vez gene da morte súbita em embriões humanos
Pesquisadores conseguem corrigir doenças hereditárias severas usando CRISPR, técnica de edição genética

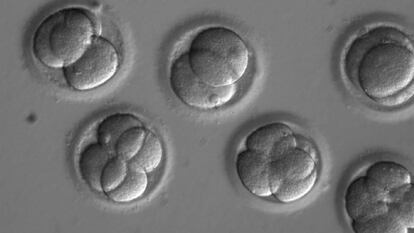
Cientistas dos EUA, Coreia do Sul e China conseguiram eliminar pela primeira vez uma doença hereditária em embriões humanos. A pesquisa representa um passo fundamental para futuras terapias destinadas a corrigir certos tipos de câncer, assim como 10.000 doenças raras que surgem quando uma das duas cópias de um gene sai errada. Também se trata de um toque de atenção para toda a sociedade, pois essa técnica permite ao ser humano alterar o seu destino biológico ao introduzir mudanças nas células germinais – óvulos, espermatozoides e embriões – que serão transmitidas para sempre de geração em geração.
Os pesquisadores se centraram na miocardiopatia hipertrófica, uma doença cardíaca frequente que provoca a morte súbita de esportistas e pessoas jovens. Uma das principais causas da doença é que uma das duas cópias do gene MYBPC3 é defeituosa.
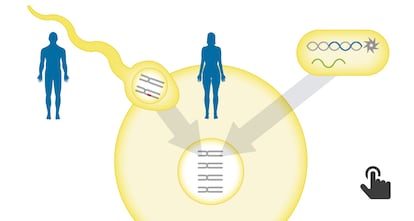
Os cientistas usaram a tecnologia CRISPR, que permite modificar o genoma de qualquer ser vivo com muita facilidade, para corrigir a mutação em espermatozoides de um homem portador da doença. Os cientistas injetaram ao mesmo tempo os espermatozoides e uma sequência do CRISPR com a versão correta do gene em óvulos doados por mulheres sãs. Dos 58 embriões resultantes, 42 se desenvolveram sem a mutação que causa a doença, uma taxa de sucesso de 72%. Pela primeira vez, foi obtido número substancial de embriões totalmente viáveis, sem erros genéticos adicionais que pudessem causar problemas de saúde num futuro bebê e em seus descendentes. Nenhum dos embriões estava destinado à implantação, razão pela qual foram destruídos dias depois da experiência.
Em 2015, cientistas chineses foram os primeiros a modificar embriões humanos com esta técnica. O trabalho mais recente, publicado este ano, conseguiu corrigir um gene que provoca a beta-talassemia, um tipo de anemia. No entanto, nenhum dos três estudos conseguiu curar todas as células do embrião, mas apenas uma parte — um problema conhecido como mosaicismo —, ou evitar mutações adicionais no genoma, o que desaconselhava um possível uso terapêutico. As pesquisas também deram origem a um debate internacional sobre os limites éticos a serem impostos sobre esta tecnologia e canais legais para aplicá-la em casos apropriados.
Pela primeira vez se conseguiu que um número substancial de embriões seja totalmente viável
O avanço “abre portas para que esta tecnologia possa ser levada algum dia à clínica, obviamente com todas as precauções necessárias, sempre se houver consenso na sociedade e se a lei assim permitir”, destaca o bioquímico espanhol Juan Carlos Izpisúa, pesquisador do Instituto Salk e coautor da pesquisa, publicada nesta quarta-feira na revista Nature.
O trabalho é resultado da colaboração entre os maiores especialistas do mundo em vários campos envolvidos. A manipulação de embriões foi realizada na Universidade de Saúde e Ciência do Oregon (EUA) e liderada por Shoukhrat Mitalipov, que já conseguiu a primeira clonagem terapêutica humana. Entre os participantes também estão o especialista em edição genética Jin-Soo Kim, do Instituto de Ciências Básicas da Coreia do Sul, e vários pesquisadores do Instituto de Genômica de Pequim e do Laboratório de Engenharia de Diagnóstico Molecular de Shenzhen, que analisaram o genoma dos embriões para comprovar que não continham erros.
A chave do sucesso estava em injetar o CRISPR juntamente com o esperma no óvulo, e não depois, quando o embrião já está formado, como fizeram os pesquisadores chineses. “Se você fizer isso nesta fase, o processo é quase perfeito, funciona sempre, mas temos que ver se funciona igualmente bem em cada caso particular,” explica Izpisúa, cuja equipe no Salk supervisionou a edição genética das células e embriões.
A técnica ainda não está pronta para ser usada em humanos. O próximo passo será melhorar sua eficiência. O diagnóstico pré-implantacional, que permite analisar o genoma de um embrião produzido por fertilização in vitro antes de ser implantado na mãe, tem uma taxa de sucesso de 50% (apenas metade dos espermatozoides transporta o gene defeituoso). O uso do CRISPR agora eleva essa taxa para mais de 70%, o que permitiria, por exemplo, menos desperdício de embriões em processos de reprodução assistida. Mas o desejável é chegar a 90% ou mesmo 100% de eficácia antes de pensar em aplicá-la em humanos, afirmou Mitalipov na terça-feira durante uma conferência de imprensa.
Outro passo iminente da equipe é corrigir mutações nos genes BRCA1 e 2, associados com um risco muito elevado de câncer da mama e de ovário, usando a mesma técnica. Num passo mais a longo prazo, seria necessário realizar ensaios clínicos para transplantar “embriões às mães e depois acompanhar a saúde de seus filhos”, disse Mitalipov. Esse ensaio “exigiria acordos parlamentares para mudar as leis dos EUA e de muitos outros países. Ainda há um longo caminho pela frente”, alertou.
Izpisúa vislumbra duas futuras aplicações para esta tecnologia. A primeira seria nos “precursores dos gametas masculinos e femininos para casais com síndromes recessivas muito severas. Desse modo, a correção gênica não se faria no embrião, mas nas células precursoras dos gametas e certos aspectos éticos e de segurança seriam mitigados”, explica. Com essa intervenção seria possível corrigir, por exemplo, as mutações de câncer de mama e ovário.
A segunda opção é usar o CRISPR diretamente no útero para corrigir “doenças genéticas severas, como a trissomia que dá origem à síndrome de Down, em estados de gestação avançados”, especifica. Nesses casos o processo não seria perfeito, pois não seriam corrigidas todas as células do feto. Mas o CRISPR poderia ser direcionado aos órgãos mais afetados, por exemplo, cérebro e coração, com a esperança de mudar células suficientes para corrigir o problema. “Ainda nos faltam muitas pesquisas. Por ora, falamos de corrigir somente uma mutação, de modo que esta tecnologia não seria extensiva a outros problemas”, observa Izpisúa.
O bioquímico espanhol foi um dos membros de um painel internacional de cientistas reunido pela Academia de Ciências dos Estados Unidos que publicou um documento no início do ano apontando quais usos da técnica CRISPR devem ser permitidos. A tecnologia, diziam, deve ser usada somente nos casos em que seja o último recurso para evitar doenças graves e nunca para tentar melhorar a capacidade física ou mental de um indivíduo, algo que, para Izpisúa, atualmente nem sequer seria possível do ponto de vista técnico. “O que mais me preocupa é que essas tecnologias sejam de utilidade para todos, como têm sido as vacinas, e não só para os ricos”, comenta.
Testar a técnica em pessoas requer mudar as leis que regulamentam a reprodução assistida e a pesquisa em muitos países, incluindo a Espanha
O trabalho deixa também uma importante surpresa do ponto de vista do conhecimento básico da biologia humana. As sequências da CRISPR contêm guias de ARN que buscam o ponto exato do genoma sobre o qual se deve intervir e enzimas que bloqueiam o fragmento defeituoso. A sequência também inclui um molde com a versão correta do gene. Assim que é feita a intervenção no genoma, os mecanismos naturais de reparação da célula voltam a pegar a sequência genética adicionando a versão proporcional. A grande surpresa é que os óvulos não usam a versão introduzida pela CRISPR, mas duplicam a própria cópia correta do gene que já portam em seu genoma.
Este fenômeno não tinha sido observado antes nem em animais de laboratório nem nas células somáticas humanas, as que dão origem a todos os tecidos do corpo, o que indica que as células reprodutoras têm um mecanismo único e robustíssimo de autoproteção que não se dá bem com adições externas. Do ponto de vista evolutivo faz todo o sentido, pois são as células encarregadas de perpetuar a espécie. Uma das primeiras perguntas a responder é se isto impede corrigir defeitos genéticos quando eles estão no óvulo e não no espermatozoide.
Escassas aplicações no curto prazo
Esta pesquisa não teria sido possível na Espanha. A lei proíbe expressamente criar embriões para pesquisa. Só podem ser usados aqueles que forem descartados nas clínicas de reprodução assistida. O rápido avanço da tecnologia – a CRISPR foi a descoberta do ano 2015 – pega de surpresa a sociedade e os governantes. “Isto era algo que tinha que acontecer”, afirma Ángel Raya, presidente eleito da Sociedade Espanhola de Terapia Gênica e Celular. “Agora temos de pensar em que queremos usá-lo. Modificar a linha germinal intencionalmente é uma barreira ética em muitos países e é a sociedade que deve decidir. Trata-se de uma grande decisão porque define o futuro da humanidade”, opina o também diretor do Centro de Medicina Regenerativa de Barcelona.
O motivo é que há o perigo de introduzir mudanças irreversíveis na descendência. “Se há algum defeito, o que seria preciso fazer? Impedir essa pessoa de ter filhos e eliminar sua descendência?”, reflete Raya. Em sua opinião, “a única justificativa possível seria quando houver uma doença que não pode ser solucionada de outra forma”. O problema, acrescenta, é que por ora “se conhecem poucos casos em que representaria uma vantagem significativa no que diz respeito ao diagnóstico pré-implantacional".

Esta conquista é “surpreendente e preocupante ao mesmo tempo”, diz Lluís Montoliu, membro do comitê de bioética do Conselho Superior de Pesquisas Científicas. “São resultados muito convincentes e demonstram que para reparar um gene não é preciso nem sequer um fator exógeno, o próprio óvulo o repara”, acrescenta. “O preocupante é que esta pesquisa também viola o Protocolo de Oviedo”, um pacto europeu sobre medicina e biologia firmado por 29 países, incluindo a Espanha, “e no qual não estão os EUA, China nem Reino Unido”, afirma.
Montoliu também observa que a aplicação dessa técnica em gametas “só seria útil em um reduzidíssimo número de casos”, no restante o diagnóstico pré-implantacional permitiria identificar e descartar os embriões com defeitos genéticos. O que realmente importa é a futura aplicação nas células somáticas. Estudos em ratos demonstraram que a CRISPR permite reverter 10 doenças monogênicas – causadas por um só gene – diferentes, diz Montoliu. Se for possível transpor isso para humanos, “um número muito mais elevado de pacientes” seria beneficiado, ressalta.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.








































